La anovulación es una de las causas comunes de infertilidad. El síndrome de ovario poliquístico (SOP) es el trastorno anovulatorio crónico más común. Hasta donde sabemos, la resistencia a la insulina está significativamente asociada con el SOP. Por lo tanto, en pacientes con SOP, los medicamentos sensibilizantes a la insulina como la pioglitazona Se puede utilizar para estimular la ovulación.
Sesenta y un pacientes con SOP se incluyeron en el estudio de acuerdo con los criterios de inclusión/exclusión luego de obtener la aprobación del Comité de Ética de la Universidad Médica de Mashhad. Los pacientes se dividieron en dos grupos. El primer grupo tomó 30 miligramos (mg) de pioglitazona diariamente a partir del segundo día de su período menstrual. La segunda recibió un placebo. 150 mg decitrato de clomifenose administró del día 3 al día 7 del ciclo menstrual. A todas las mujeres se les realizó ecografía vaginal y, en los casos de folículos maduros, se realizó inseminación intrauterina previa inyección de gonadotropina coriónica humana. Se comparó la estimulación ovárica y las tasas de embarazo en cada grupo.
No hubo diferencias entre los grupos en términos de características demográficas y tipos de infertilidad. El índice de masa corporal fue mayor en el grupo de pioglitazona (28,3 ± 3,8 vs 26,2 ± 3,5, valor de P = 0,047). El tamaño del folículo no difirió significativamente entre los grupos (2,2 ± 1,4 frente a 1,3 ± 1,1, valor de P = 0,742). Las tasas de embarazo [4 (12,9 %) frente a 4 (13,3 %), valor de P = 1] no difirieron entre los grupos.

A pesar del mayor número de folículos en el grupo de pioglitazona, nuestro estudio no mostró diferencias en la estimulación ovárica y las tasas de embarazo.
La infertilidad afecta aproximadamente al 10-15 % de las parejas. El 30 % de la infertilidad femenina se debe a fallas en la ovulación [1]. El síndrome de ovario poliquístico (SOP) es el trastorno más obvio y común asociado con los trastornos ovulatorios crónicos [2]. Según los criterios de diagnóstico de la Sociedad para la Reproducción Humana y la Embriología y la Sociedad Estadounidense de Medicina Reproductiva (ESHRE/ASRM), la prevalencia del SOP es aproximadamente del 15 al 20 % [3].
Los niveles anormales de lipoproteínas son típicos de los pacientes con SOP, con niveles elevados de colesterol total (Chol), triglicéridos (TG), lipoproteínas de baja densidad (LDL), lipoproteínas de alta densidad (HDL) e IA apoptótica [4], 5,6]. El cambio más significativo en los lípidos informado fue una disminución en el HDL. La hiperinsulinemia y la resistencia a la insulina (IR) son comunes en el SOP. Mustafa et al. Se encontró que alrededor del 46 % de las mujeres egipcias con SOP tenían IR [4, 7]. La insulina altera esteroidogénesis en el ovario independiente de la secreción de gonadotropina I PCOS [1]. Los receptores de insulina y el factor de crecimiento similar a la insulina-1 (IGF-I) están presentes en las células del estroma ovárico [5]. Disminución de la autofosforilación, un trastorno específico asociado con el receptor de insulina- señalización mediada, se detecta en el 50% de las mujeres con SOP [3].
El metabolismo anormal de la glucosa mejora significativamente la pérdida de peso;la pérdida de peso puede reducir el hiperandrogenismo y restaurar la función ovulatoria [7]. Las mujeres obesas con resistencia a la insulina, restricción calórica y pérdida de peso reducen la gravedad de la resistencia a la insulina. Por otro lado, una disminución en la concentración de insulina reduce la producción de andrógenos [8].
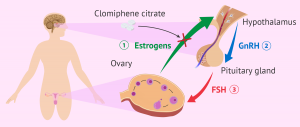
Este Dia,citrato de clomifenoes el tratamiento recomendado para la inducción de la ovulación en mujeres con SOP. La resistencia a la insulina se asocia significativamente con el síndrome de ovario poliquístico, por lo que se consideran fármacos que aumentan la sensibilidad del receptor de insulina, como la metformina y las beta-tiazolidinedionas, en el tratamiento de estas pacientes. Tratamiento de la insulina la resistencia puede inducir la ovulación, especialmente en mujeres obesas con un mayor grado de resistencia a la insulina [9].
La resistencia a la insulina implica una respuesta reducida de la glucosa a la insulina, seguida de hiperinsulinemia, lo que conduce a triglicéridos elevados, colesterol HDL reducido, intolerancia a la glucosa y riesgo cardiovascular [10]. La pioglitazona, utilizada para tratar la diabetes tipo 2, afecta directamente la sensibilidad periférica a la insulina. En algunos estudios recientes, se ha demostrado que la pioglitazona reduce el flujo sanguíneo del estroma intraovárico. Puede ayudar a mejorar la estimulación ovárica y los resultados de la fertilización in vitro (FIV) en pacientes con SOP. Coffler demostró que la pioglitazona puede inducir significativamente la ovulación en pacientes hiperinsulinémicas [11] .
Hasta la fecha, ningún estudio ha examinado el efecto de la pioglitazona sobre la fertilidad en nuestras pacientes. Por lo tanto, planteamos la hipótesis de que la pioglitazona como desinfectante de insulina podría mejorar las tasas de ovulación y embarazo en pacientes con SOP. embarazos clínicos y el número de folículos grandes en mujeres infértiles con SOP.
La Universidad Médica de Mashhad supervisó este estudio de ensayo clínico aleatorizado de 2014 a 2017 y utilizó un método de muestreo no probabilístico para reclutar a 61 pacientes con SOP que fueron derivadas al Centro de Infertilidad Milad para el tratamiento de la infertilidad. El comité de ética de la Universidad Médica de Mashhad aprobó la moratoria en “15 de marzo de 2014″ y se obtuvo el consentimiento informado por escrito de todos los participantes.
Los criterios de inclusión fueron mujeres infértiles de 18 a 38 años con histerosalpingografía y espermograma normales. El diagnóstico de síndrome de ovario poliquístico se basa en los criterios AES (Androgen Excess Society 2006) basados en los criterios anteriores: (1) hirsutismo o síntomas hiperandrogénicos. (2) ) La disfunción ovárica es oligomenorrea, o el ovario poliquístico se diagnostica como una apariencia de encaje cervical mediante ecografía;(3) La promoción de causas secundarias como tumores ováricos y suprarrenales y adenomas hipofisarios. El síndrome de ovario poliquístico se diagnostica si el ciclo menstrual es oligomenorrea, o si el número de folículos periféricos en el ovario es 2-9 mm mayor que 9 en el Escala de Ferriman-Gallway.
Se excluyeron los pacientes con antecedentes de enfermedad cardiovascular crónica, enfermedad renal crónica, diabetes, enfermedad tiroidea y enfermedad pulmonar.

Después de seleccionar a los pacientes elegibles, se dividieron en dos grupos mediante un muestreo aleatorio simple utilizando un software informático. Se utilizó el método del sobre para asignar aleatoriamente a los pacientes a los grupos de estudio. De esta forma, el número aleatorio se colocará en un sobre cerrado. el sobre no se puede ver desde el exterior. El grupo A contenía 30 tabletas de pioglitazona, 30 mg y 15 tabletas de clomifeno, mientras que el grupo B se colocó con 30 tabletas de placebo y 15 tabletas de clomifeno. Los pacientes desconocían el tratamiento asignado.
Todas las pacientes se sometieron a una ecografía transvaginal el segundo día de la menstruación y se incluyeron en el estudio si no había quistes ováricos mayores de 20 mm.
Se evaluó el número de folículos medianos y grandes y el grosor del endometrio al décimo u undécimo día de la menstruación. Se evaluaron las tasas de embarazo clínico y químico.
El primer grupo recibió 30 mg de pioglitazona al día;el segundo grupo recibió un placebo a partir del segundo día de la menstruación. Entre los días 3 y 7 del ciclo menstrual, ambos grupos recibieron 150 mg decitrato de clomifeno.Ultrasonografía transvaginal el día 10 u 11.Considerar gonadotropina coriónica humana (HCG) seguida de inseminación intrauterina (IIU) en mujeres con grosor endometrial mayor de 7 mm y folículos mayores de 16 mm.
En el caso de un retraso de 5 días en la menstruación, se tomaron muestras de sangre para evaluar los niveles de βHCG. Durante el estudio se evaluaron los efectos secundarios relacionados con la pioglitazona y el número de folículos mayor de 16 mm y el grosor del endometrio. Finalmente, se evaluaron la estimulación ovárica y las tasas de embarazo. comparado entre grupos.
El tamaño de la muestra se calculó con el software PASS 11 y se comparó el número medio de folículos en cada grupo. Por defecto, los errores de tipo 1 son del 5 % y los errores de tipo 2 son del 20 %. Estimamos 22 pacientes por grupo, pero debido a posibles deserción, se consideraron 30 participantes por grupo.
Los datos se ingresaron en SPSS versión 16. Inicialmente, las características de cada grupo se describieron mediante métodos estadísticos descriptivos, incluidas medias y desviaciones estándar para variables continuas y frecuencias numéricas más para variables categóricas. Luego, para comparar variables cuantitativas en los dos grupos de estudio, Se utilizaron pruebas t independientes o pruebas de Mann-Whitney-U después de evaluar la normalidad mediante la prueba de Kolmogorov-Smirnov. Las variables cualitativas se compararon mediante la prueba de chi-cuadrado. En todas las estadísticas, los valores de P inferiores a 0,05 se consideraron niveles significativos. .
En cuanto a los criterios de inclusión, participaron en el estudio 93 mujeres, 19 tenían criterios de exclusión y 13 abandonaron. Treinta pacientes fueron clasificadas en el grupo placebo y 31 en el grupo intervención. El algoritmo CONSORT se muestra en la Figura 1. Las características demográficas de las mujeres son se muestra en la Tabla 1. No hubo diferencias entre los grupos en cuanto a las características demográficas y el tipo de infertilidad. La edad promedio del grupo de intervención fue de 28,20 ± 5,46 años y la del grupo control de 27,07 ± 4,18 años, y la diferencia no fue estadísticamente significativa. Sin embargo, el índice de masa corporal (IMC) fue mayor en el grupo de pioglitazona.
La Tabla 2 resume los hallazgos ecográficos de la paciente, como el número de folículos medianos, el número de folículos grandes, el tamaño máximo del folículo y el grosor del endometrio. Como se muestra en la Tabla 2, el tamaño de los folículos estaba en el grupo excepto el folículos de tamaño mediano.
La información sobre los resultados del tratamiento de inducción de la ovulación, como el volumen de ovulación, la química y las tasas de embarazo clínico por ciclo, se presenta en la Tabla 3. La estimulación ovárica y las tasas de embarazo no difirieron entre los grupos.
Los resultados de este estudio mostraron que hubo una diferencia significativa en el número de estimulaciones de la ovulación entre las pacientes tratadas con pioglitazona. La ecografía, realizada el día 10 de la menstruación, mostró un aumento significativo en el número medio de folículos en el grupo de intervención. Nuestros hallazgos confirman los hallazgos de un estudio de 2012 sobre el papel de la pioglitazona en la inducción de la ovulación en pacientes hiperinsulinémicas con SOP [12]. Morley et al. También se ha informado un aumento de la ovulación en pacientes con SOP que toman pioglitazona [13].
No hubo diferencias en las tasas de ovulación y embarazo entre los dos grupos de estudio. Esto puede deberse a la duración de la pioglitazona utilizada antes de comenzar con el clomifeno. Ota demostró que los resultados de 2008 mostraron que 7 de 9 pacientes que tomaron pioglitazona durante 12 a 30 semanas antes el clomifeno quedó embarazada [14]. El estudio de Kim de 2010 mostró una reducción significativa en la cantidad de folículos después de que se administró pioglitazona. Además, en su estudio, el grupo de pioglitazona tuvo una tasa de embarazo clínico más alta, pero esta diferencia no fue estadísticamente significativa. Este hallazgo contrasta con nuestros resultados, pero puede explicarse por los criterios de selección de pacientes, incluidos los pacientes resistentes al clomifeno [15].
Ota demostró que la pioglitazona podría mejorar las tasas de embarazo en pacientes con SOP resistentes al clomifeno y la dexametasona [14]. Parece que los casos de SOP con hiperandrogenemia deben seleccionarse con más cuidado. Las pacientes en el programa Ota tienen diferentes niveles de hormonas, lo que puede afectar el resultado de tratamiento con pioglitazona. En nuestro estudio, los niveles hormonales no difirieron significativamente antes y después de la intervención.
En nuestro estudio, no hubo diferencias significativas en el número de folículos grandes y grosor endometrial entre los grupos de intervención y control. Sin embargo, hubo un aumento significativo en el número de folículos de tamaño mediano en el grupo de intervención.
En el presente estudio, el grupo de intervención tenía un IMC más alto, lo que significa que este grupo puede tener más probabilidades de desarrollar hiperinsulinemia y afectar el resultado, aunque esta diferencia no fue estadísticamente significativa entre los dos grupos.
Ninguno de nuestros pacientes experimentó efectos secundarios. No hubo cambios estadísticamente significativos en las pruebas de función hepática durante el período de estudio.
Una limitación importante de nuestro estudio fue que el estudio se diseñó como un proyecto de casos y controles, lo que resultó en diferencias en el IMC entre los dos grupos. Por lo tanto, los resultados pueden verse afectados por esta diferencia. Sin embargo, no existen estudios similares de estos dos grupos. Sin embargo, debido al efecto de la pioglitazona sobre la resistencia a la insulina, parece que las tasas de éxito aumentan si los pacientes reciben pioglitazona durante un período de tiempo más largo antes de comenzar la dieta con clomifeno. Por lo tanto, se recomienda más investigación para determinar el mejor momento para usar pioglitazona.
A pesar de la mayor cantidad de folículos en el grupo de pioglitazona, nuestro estudio no mostró diferencias en la estimulación ovárica y las tasas de embarazo entre los dos grupos.
De hecho, hemos tratado con eficacia problemas específicos como la infertilidad, el sangrado por disfunción uterina y el hirsutismo en el pasado. Ahora tenemos la oportunidad (y de hecho la responsabilidad) de proporcionar intervenciones para prevenir o corregir algunas de las complicaciones metabólicas de la infertilidad (que puede afectar significativamente la salud en general, así como la calidad y cantidad de vida).
Hora de publicación: 30-mar-2022
